Трансгенные Животные Презентация
Трансгенные животные были получены экспериментальным путем. Они содержат во всех своих. Введение Трансгенные животные это экспериментально полученные животные, содержащие во всех клетках своего органызма дополнительную.
Идентификация клеток, несущих трансген в специфическом сайте, при помощи ПЦР. В результате неспецифического встраивания векторной ДНК один из праймеров (Р2) не сможет гибридизоваться с участком хромосомы, находящимся на определенном расстоянии от места отжига праймера Р1, и фрагмента нужного размера при амплификации не образуется. Р1 гибридизуется с уникальным участком (US) встроенной ДНК, отсутствующим в хромосомной ДНК клетки-реципнента. В результате гомологичной рекомбинации между участками НВ1 и НВ2 встраиваемой ДНК, с одной стороны, и комплементарными участками хромосомы СS1 и СS2, с другой, образуются участки, с которыми могут гибридизоваться оба праймера, Р1 и Р2, и которые находятся на определенном расстоянии друг от друга. В ходе ПЦР-амплификации синтезируются фрагменты одного размера, которые можно идентифицировать при помощи гель-электрофореза. Если ПЦР-продукт нужной длины образовался, значит трансген (ТG), находящийся между гомологичными участками (НВ1 и НВ2), встроился в определенный сайт хромосомы. «Нокаут» гена с помощью направленной гомологичной рекомбинации.
Вектор несет селективный маркерный ген (smg) и фланкирующие его последовательности, гомологичные соответствующим участкам гена-мишени. Последний содержит пять экзонов (1 – 5).

В результате гомологичной рекомбинации (штриховые линии) ген-мишень прерывается («нокаутируется»). Клонирование с помощью переноса ядра Плюрипотентность можно выявить, если перенести ядро тестируемой клетки в яйцеклетку с удаленным ядром и затем исследовать способность последней к развитию и образованию жизнеспособного потомства. В нескольких лабораториях с переменным успехом исследовали плюрипотентность линий эмбриональных клеток, клеток плода и взрослой особи. Было показано, что ядра эмбриональных клеток способны - хотя и с низкой эффективностью — обеспечивать развитие. Например, с помощью переноса ядер эмбриональных клеток крупного рогатого скота, культивированных непродолжительное время, были получены жизнеспособные особи.
Всем известная овца по имени Долли была клонирована с помощью переноса ядра клетки молочной железы (вымени) взрослого животного (рис. Так впервые была доказана плюрипотентность ядра дифференцированной взрослой клетки.
Впрочем, нельзя исключить, что на самом деле донорское ядро было взято из недифференцированной клетки, присутствовавшей в эпителии молочной железы организма-донора. Клонирование Долли из ядра дифференцированной клетки и трех других овец из ядер эмбриональных клеток удалось осуществить благодаря переносу ядер из клеток, находящихся в стадии покоя (G 0), и, возможно, особенностям эмбриогенеза этого животного. Дело в том, что в течение первых трех делений зиготы овцы, занимающих несколько суток, происходит только репликация ДНК, ни один из генов не экспрессируется. Предполагается, что за это время введенная ДНК освобождается от специфичных для клетки регуляторных белков, а соответствующие гены эмбрионального развития связываются с инициаторными эмбриональными белковыми факторами из цитоплазмы яйцеклетки. Основная проблема, которую нужно решить для того, чтобы создание трансгенных животных с помощью метода переноса ядер стало реальным, — это сохранение плюрипотентности клеток в непрерывной культуре. Если это удастся, то генетическое изменение таких клеток и создание трансгенных организмов станет почти рутинной процедурой.
Однако вследствие видовых различий во времени процесса деления клетки на ранних стадиях эмбриогенеза и инициации транскрипции в этот период пока не ясно, удастся ли осуществить перенос ядра в случае каких-либо других домашних животных, кроме овец, если донорское ядро будет находится на той же стадии, что и яйцеклетка. Клонирование овцы методом переноса ядра. Ядро яйцеклетки удаляют с помощью микропипетки. Культивируют эпителиальные клетки молочной железы взрослой особи и индуцируют их переход в фазу G.
Осуществляют слияние клетки в G o-фазе и яйцеклеток, лишенных ядра, и выращивают восстановленные яйцеклетки в культуре или в яйцеводе с наложенной лигатурой до ранних стадий эмбриогенеза, а затем имплантируют их в матку «суррогатной» матери, где и происходит дальнейшее развитие. В эксперименте, описанном Уилмутом и др., было проведено слияние 277 яйцеклеток с удаленными ядрами с клетками молочной железы в фазе G о; из 29 эмбрионов только один развился до жизнеспособного плода. Перенос генов с помощью искусственных дрожжевых хромосом Хромосомы высших организмов содержат в своем составе протяженные молекулы ДНК. Например, длина ДНК одной из типичных хромосом человека составляет 100–200 миллионов пар оснований (м.п.о.).
Исследование генов в хромосомах высших растений, животных и человека потребовало создания векторов для клонирования фрагментов ДНК длиной в несколько сотен тысяч пар оснований. Этим задачам отвечает недавно созданная система для клонирования сверхдлинных молекул ДНК на основе искусственно полученной мини-хромосомы дрожжей YAC (yeast artificial chromosome).
YAC-вектор представляет собой кольцевую молекулу ДНК, содержащую ряд генетических элементов, которые позволяют ей существовать во внехромосомном состоянии в клетках дрожжей (рис. 9). Вектор заключает в себе две теломерные последовательности нуклеотидов TEL, необходимые для репликации концов мини-хромосомы, и область начала репликации ARS1, соединенную с последовательностью центромеры. Все эти функциональные элементы требуются для репликации YAC-вектора и его правильной передачи в дочерние ядра во время митоза. Кроме того, вектор содержит два селектируемых маркера TRP, восстанавливающих способность к росту ауксотрофных по триптофану клеток дрожжей в отсутствие экзогенного триптофана, а также маркер URA3, компенсирующий генетический дефект клеток дрожжей, который нарушает биосинтез урацила. В векторе имеется также ген супрессорной тРНК sup4, являющийся селектируемым маркером для поддержания вектора в мутантных бактериальных клетках, содержащих амбер-мутации в жизненно важных генах.
Помимо этого, он обладает последовательностями нуклеотидов, необходимыми для его репликации в бактериальных клетках. При подготовке к клонированию YAC-вектор, выделенный в виде плазмиды, расщепляют рестриктазой BamHI и отделяют от образовавшегося короткого фрагмента ДНК, который не требуется для репликации YAC-вектора в дрожжах (этап 1). После этого проводят второе расщепление вектора рестриктазой EcoRI, сопровождающееся образованием двух его 'плеч', каждое из которых на одном из концов содержит теломерные последовательности хромосомы дрожжей (этап 2). На заключительном этапе (3) полученные 'плечи' лигируют с крупными EcoRI-фрагментами клонируемой ДНК, которые получают путем частичного расщепления высокомолекулярной хромосомной ДНК, предназначенной для клонирования.
Полученными таким образом рекомбинантными ДНК трансформируют протопласты клеток дрожжей, и образовавшиеся трансформанты отбирают на селективной твердой питательной среде. В таком векторе удавалось осуществлять клонирование фрагментов ДНК длиной до 700 т.п.о.
При всех своих достоинствах системы клонирования, основанные на векторах семейства YAC, обладают рядом существенных недостатков. В рекомбинантных ДНК, поддерживаемых в таких системах, часто возникают внутренние делеции. Кроме того, при введении рекомбинантных ДНК в клетки дрожжей иногда имеет место проникновение в одну клетку нескольких молекул вектора со вставками. В итоге отдельные клоны дрожжевых клеток могут содержать несколько несцепленных друг с другом молекул рекомбинантных ДНК, а рекомбинация между ними вообще может приводить к образованию химерных молекул. Все это очень затрудняет физическое картирование генов в хромосомах исследуемых объектов. Рис. 9. Схема клонирования сверхдлинных молекул ДНК с использованием вектора YAC 1 – линеаризация ДНК вектора рестриктазой BamHI; 2 – расщепление линеаризованной ДНК вектора рестриктазой EcoRI с образованием 'плечей'; 3 – введение в вектор клонируемого EcoRI-фрагмента ДНК Трансгенных мышей получали микроинъекцией в пронуклеус оплодотворенной яйцеклетки или трансфекцией ЕS-клеток с помощью YАС, несущих несколько родственных генов или один большой ген. Трансгенные мыши, несущие кластер из пяти функциональных генов β-глобина человека суммарной длиной примерно 250 т.
Трансгенные Животные Презентация
Н., экспрессировали все эти гены тканеспецифично и в нужное время — точно так же, как это происходит у человека. Такое соответствие обеспечивалось фланкирующими их последовательностями, которые содержат промотор и другие важные регуляторные элементы. Создание мышей, которые синтезировали бы только человеческие антитела, — это примечательный пример трансгеноза с помощью YАС. Моноклональные антитела можно использовать для лечения некоторых заболеваний человека. Однако получить человеческие моноклональные антитела практически невозможно. К сожалению, и моноклональные антитела грызунов иммуногенны для человека. Чтобы «очеловечить» существующие моноклональные антитела грызунов, были разработаны сложные стратегии с использованием рекомбинантных ДНК.
В результате этих трудоемких процедур удалось получить Fv- и Fab-фрагменты, зачастую обладающие каким-то сродством к специфическому антигену. Возможно, технологического прорыва удастся достичь, если использовать для получения полноразмерных человеческих антител более доступный метод с использованием гибридом. Синтез природных антител — это настоящее чудо. Антитело — очень сложная тетрамерная конструкция, состоящая из двух пар разных цепей. Одна из них называется тяжелой (Н), а другая - легкой (λ или κ). Эти термины отражают различия в молекулярных массах субъединиц антитела. Генетические особенности каждой тяжелой цепи определяются комбинацией вариабельного (V H), дивергентного (D H), шарнирного (J H) и константного (С H) участков (доменов) соматической ДНК в В-клетке.
Известны два типа легких цепей, λ и κ, которые образуются в результате перестройки их собственных вариабельных (Vλ, Vκ, шарнирных (Jλ, Jκ) и константных (Сλ, Сκ) доменов. Данная В-клетка синтезирует один вид антител, с уникальной комбинацией участков, составляющих Н-цепь, и либо перестроенной λ-, либо κ-цепью. Набор генетических элементов, обеспечивающих образование множества разных Н-цепей антител человека, включает около 95 V H-доменов, 30 D H-доменов, 6 J H-доменов и 5 основных константных (Сα, Сγ, Сδ, Сε, Сμ) доменов. Локус κ-генов содержит примерно 76 Vκ-доменов, 5 Jκ-доменов и один константный (Сκ) участок.
Размер Н-локусов и κ-генов — от 1 до1,5 т. Для создания трансгенных мышей, способных синтезировать множество различных человеческих антител, необходимо инактивировать мышиные гены Н- и L-цепей, а затем встроить в хромосомную ДНК мыши YАС, содержащую гены Н- и L-цепей каждого человеческого гена иммуноглобулина. Чтобы решить эту задачу, мышиные гены Н- и κ-цепей были заменены («нокаутированы») небольшим участком кластера генов Н-цепи человека и кластера генов κ-цепи человека. Трансгенные мыши с таким набором генов антител человека синтезировали человеческие антитела к некоторым антигенам; кроме того, были созданы гибридомы, продуцирующие человеческие моноклональные антитела.
Однако разнообразие человеческих антител, продуцируемых такими трансгенными мышами, было невелико вследствие ограниченности набора вариабельных сегментов Н- и κ-цепей. Чтобы решить эту проблему, создали YАС с большим числом генов вариабельных участков Н- и κ-цепей гемоглобина человека. Объединив четыре разные YАС с генами Н-цепей гемоглобина человека, создали YАС длиной 1000 т. Н., несущую 66 V H-доменов, около 30 D H-сегментов, 6 J H-доменов, Сμ, Сδ и Сγ. Аналогично, из трех YАС, несущих различные домены Vκ, создали YАС длиной 800 т. С 32 Vκ-доменами, 5 Jκ-доменами и Сκ.
ЕS-клетки трансфицировали по отдельности YАС с генами Н- и κ-цепей методом слияния клеток, отобрали клетки, в которых произошла интеграция YАС, с помощью селективного маркера и проверили целостность каждой вставки методом ПЦР. Инъецировали клетки, несущие встроенные гены Н- либо κ-цепи, в бластоцисты и идентифицировали особь-основателя с помощью ПЦР. Трансгенных мышей со вставками генов Н- и κ-цепей скрещивали по отдельности с мышами с инактивированными локусами этих цепей.
Затем потомство скрещивали между собой, чтобы получить мышей, лишенных функциональных мышиных генов Н- и κ-цепей, но несущих обе вставки генов Н- и κ-цепей гемоглобина человека. Трансгенные мыши с увеличенным числом человеческих V H- и Vκ-доменов синтезировали человеческие антитела. Их иммунизировали тремя разными антигенами, и в каждом случае гибридомы секретировали человеческие моноклональные антитела, обладающие высоким сродством к антигену, которым животные были иммунизированы. Весьма вероятно, что с помощью такой трансгенной системы удастся получать человеческие моноклональные антитела для использования их в медицине. Трансгенные мыши: применение Трансгенные мыши могут служить модельными системами для изучения болезней человека и тест-системами для исследования возможности синтеза продуктов, представляющих интерес для медицины.
Используя целых животных, можно моделировать и возникновение патологии, и ее развитие. Однако мышь — не человек, хотя она тоже относится к классу млекопитающих, поэтому данные, полученные на трансгенных моделях, не всегда можно экстраполировать на человека в том, что касается медицинских аспектов. Тем не менее в некоторых случаях они позволяют выявить ключевые моменты этиологии сложной болезни. Принимая во внимание все это, ученые разработали «мышиные» модели таких генетических болезней человека, как болезнь Альцгеймера, артрит, мышечная дистрофия, образование опухолей, гипертония, нейродегенеративные нарушения, дисфункция эндокринной системы, сердечно-сосудистые заболевания и многие другие.
Трансгенный крупный рогатый скот Если предполагается использовать молочную железу в качестве «биореактора», то наиболее предпочтительным животным для трансгеноза является крупный рогатый скот, который ежегодно дает до 10 000 л молока, содержащего примерно 35 г белка на 1 л. Если в молоке будет содержаться такое количество рекомбинантного белка и эффективность его очистки составит 50%, то от 20 трансгенных коров можно будет получать примерно 100 кг такого белка в год. По случайному совпадению, именно столько белка С, использующегося для предотвращения тромбообразования, требуется ежегодно.
С другой стороны, одной трансгенной коровы будет более чем достаточно для получения требуемого ежегодно количества фактора IX (фактора Кристмаса) каскадного механизма свертывания крови, который вводят больным гемофилией для повышения свертываемости крови. Для создания трансгенных коров использовали модифицированную схему трансгеноза мышей методом микроинъекций ДНК (рис. Процедура включала следующие основные этапы.

Сбор ооцитов коров, забитых на скотобойне. Созревание ооцитов in vitro. Оплодотворение бычьей спермой in vitro. Центрифугирование оплодотворенных яйцеклеток для концентрирования желтка, который в нормальных яйцеклетках мешает визуализации мужского пронуклеуса с помощью секционного микроскопа. Микроинъекция ДНК в мужской пронуклеус. Развитие эмбрионов in vitro. Нехирургическая имплантация одного эмбриона реципиентной самке во время течки.
Программы, игры, книги, фильмы. Скачать бесплатно Торрент Сваты 4 6 Серия Без Регистрации, смотреть онлайн Торрент Сваты 4 6 Серия Без Регистрации - поиск файлов. Конструктор договоров профессионал кряк.
Скрининг ДНК потомков на наличие трансгена. В тестовых экспериментах из пула в 2470 ооцитов были получены два трансгенных теленка.
Этот результат указывает на результативность описанного подхода, но также и на его низкую эффективность. Исследования в этой области продолжаются, и есть надежда на усовершенствование методики трансгеноза. Например, скоро появится возможность отбирать небольшое число клеток у развивающегося эмбриона in vitro и тестировать их на наличие трансгена; такая потеря клеток эмбрионом не помешает его нормальному развитию. Этот тест позволит имплантировать только эмбрионы, несущие трансген.
Одна из целей трансгеноза крупного рогатого скота — изменение содержания в молоке различных компонентов. Так, количество сыра, получаемого из молока, прямо пропорционально содержанию в нем κ-казеина, поэтому весьма перспективным представляется увеличение количества синтезируемого κ-казеина с помощью гиперэкспрессии трансгена этого белка. Далее, если обеспечить экспрессию гена лактазы в клетках молочной железы, то можно будет получать молоко, не содержащее лактозы.
Такое молоко незаменимо для многих людей, не переносящих лактозу; после приема молока или молочных продуктов у них возникает серьезное желудочное расстройство. Трансгеноз крупного рогатого скота — это весьма перспективный подход, но создание большого числа трансгенных животных потребует времени, ведь для того чтобы вырастить половозрелое животное из оплодотворенной яйцеклетки, нужно примерно 2 года. Весьма актуально создание домашних животных с наследственной устойчивостью к бактериальным и вирусным инфекциям и паразитарным инвазиям.
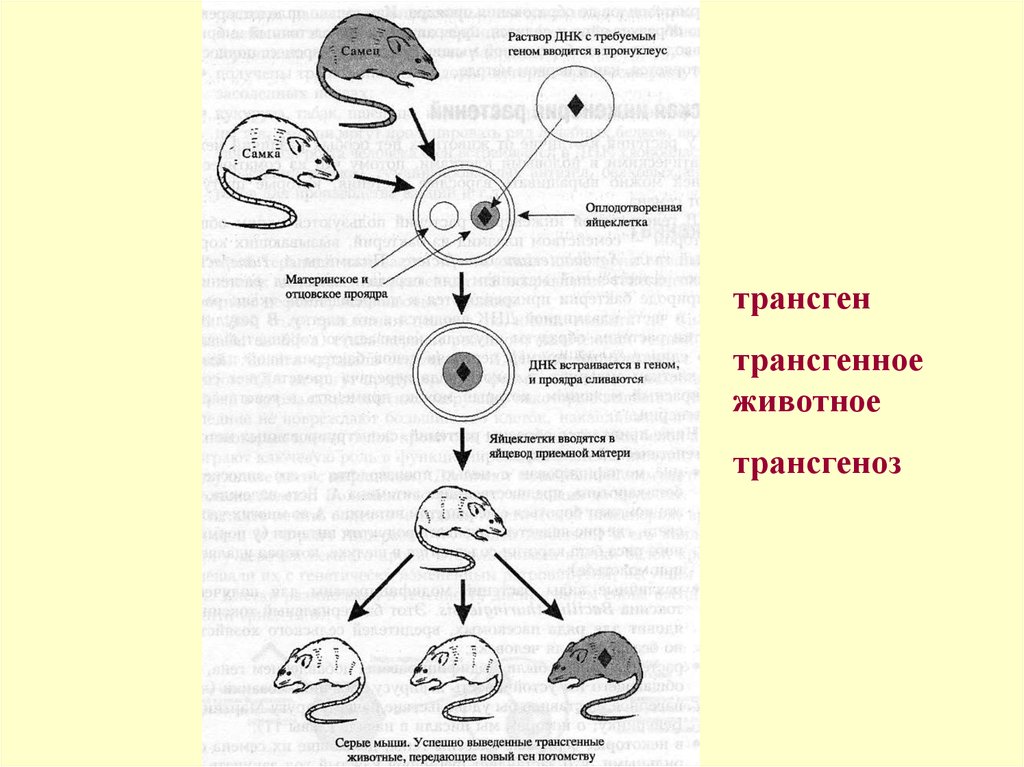
Трансгенные Животные И Растения Презентация
Известно о существовании пород с наследственной устойчивостью к бактериальным инфекционным заболеваниям - маститу (коровы), дизентерии (новорожденные поросята), холере (домашняя птица). Если в основе устойчивости к каждой из этих болезней лежит один ген, можно попытаться создать несущих его трансгенных животных.
В настоящее время для борьбы с инфекционными заболеваниями домашних животных используют прививки и лекарственные препараты. Заболевших животных изолируют, за здоровыми ведут тщательное наблюдение. Стоимость всех этих мероприятий может достигать 20% обшей стоимости конечной продукции. Для выведения линий животных, устойчивых к возбудителям инфекций, можно использовать другой подход, заключающийся в создании путем трансгеноза наследуемых иммунологических механизмов. С этой точки зрения рассматривают самые разные гены, ответственные за работу иммунной системы: гены основного комплекса гистосовместимости, Т-клеточных рецепторов, лимфокинов. Наиболее обнадеживающими на настоящее время являются предварительные результаты, полученные при введении мышам, кроликам и свиньям генов, кодирующих Н- и L-цепи какого-либо моноклонального антитела. Идея этого подхода заключается в том, чтобы снабдить трансгенное животное наследуемым механизмом защиты, позволяющим обойтись без иммунизации с помощью прививок.
Введение в организм реципиента генов антител, которые связываются со специфическими антигенами, было названо иммунизацией in vivo. Для этого гены Н- и L-цепей иммуноглобулинов моноклонального мышиного антитела к антителу, связывающемуся с 4-гидрокси-3-нитрофенилацетатом, вводили с помощью микроинъекций в оплодотворенные яйцеклетки мыши, кролика и свиньи.
Во всех случаях в сыворотке трансгенных животных обнаруживалась соответствующая активность моноклонального антитела. Однако количество моноклональных антител, содержащих цепи Н и L, было невелико.
Чтобы установить, можно ли решить эту проблему, необходимо протестировать различные трансгенные конструкции. Получение трансгенных коров. Трансгенные овцы, козы и свиньи Опыты по трансгенозу в случае овец и коз в основном были направлены на превращение молочных желез этих животных в своеобразные биореакторы для получения белковых продуктов, использующихся в медицине. Несмотря на то что надои у овец и коз меньше, чем у коров, за год они дают сотни литров молока. С помощью метода, аналогичного используемому для создания трансгенных мышей и трансгенных конструкций, содержащих гены человека под контролем промоторов, специфичных для молочных желез, были созданы трансгенные овца и коза, в молоко которых секретировались белки человека.
Они были гликозилированы и обладали активностью, близкой к таковой соответствующих белков, получаемых от человека. Однако, для того чтобы убедиться в полной эквивалентности этих белков, нужны дополнительные исследования. Экспрессия трансгенов в клетках молочных желез овец и коз не оказывала никаких побочных действий ни на самок в период лактации, ни на вскармливаемое потомство.
В отличие от этого при введении свиньям трансгена бычего гормона роста под контролем промотора металлотионеина неблагоприятные эффекты наблюдались. Количество гормона у разных особей в группе трансгенных свиней различалось, однако в целом вся эта группа быстрее прибавляла в весе. К сожалению, этот положительный результат частично обесценивался различными патологиями: у животных отмечались язва желудка, почечная недостаточность, хромота, воспаление перикарда, уменьшение подвижности суставов, предрасположенность к пневмонии. Причины этих симптомов неизвестны. Возможно, они связаны с долговременным присутствием в организме избытка гормона роста.
В этих экспериментах трансген синтезировался более или менее непрерывно. Были созданы также трансгенные овцы с повышенной скоростью роста шерсти. Для этого кДНК овечьего инсулиноподобного фактора роста I была помещена под контроль мышиного промотора гена кератина с высоким содержанием серы, что обеспечивало гиперэкспрессию кДНК. При этом у трансгенных овец в отличие от свиней никаких нежелательных побочных эффектов не наблюдалось.
Положительные результаты были получены и в ходе экспериментов с трансгенными свиньями. Например, были созданы здоровые трансгенные свиньи, в геноме которых присутствовала следующая генетическая конструкция: регуляторная область гена β-глобина человека, два гена α 1-глобина человека и один ген β А-глобина человека. В результате ее экспрессии в клетках крови свиней синтезировался человеческий гемоглобин, при этом в результате замены человеческого промотора гена β-глобина свиным человеческий гемоглобин синтезировался в значительно большем количестве.
Человеческий гемоглобин, продуцируемый трансгенными свиньями, обладал такими же химическими свойствами, что и природный человеческий. Его можно было очистить от гемоглобина свиней обычной хроматографией. Эти результаты указывают на принципиальную возможность замены цельной крови, используемой при трансфузии, человеческим гемоглобином, полученным методом трансгеноза. Однако изолированный гемоглобин переносит кислород не так эффективно, как гемоглобин в составе эритроцитов. Более того, он быстро разрушается в организме животного, которому был введен, а продукты его распада токсичны для почек.
Таким образом, получение заменителя человеческой крови с помощью трансгеноза - это дело далекого будущего. В последнее время большое внимание уделяется вопросу об использовании органов животных для трансплантации человеку.
Основная проблема межвидовой трансплантации — это гиперострое отторжение. Гиперострое отторжение влечет за собой связывание антител организма-хозяина с углеводной антигенной детерминантой на поверхности клеток пересаженного органа. Связавшиеся антитела вызывают острую воспалительную реакцию (активацию каскада комплемента), происходит массовая гибель несущих антитела клеток и быстрая потеря пересаженного органа.
В естественных условиях воспалительная реакция блокируется особыми белками на поверхности клеток, выстилающих стенки кровеносных сосудов. Эти белки — ингибиторы комплемента видоспецифичны.
Было высказано предположение, что если бы животное-донор несло один или несколько генов человеческого белка, ингибирующего комплемент, то пересаженный орган был бы защищен от первичной воспалительной реакции. С этой целью были получены трансгенные свиньи, несущие различные человеческие гены ингибитора комплемента.
Клетки одного из этих животных оказались совершенно нечувствительными к компонентам системы каскада комплемента. Предварительные эксперименты по пересадке органов трансгенных свиней приматам показали, что ткани пересаженного органа повреждаются слабее, а сам орган не отторгается немного дольше.
Возможно, трансгенные свиньи, несущие человеческий ген ингибитора комплемента и лишенные основного поверхностного белка клеток свиней, который вызывает острейшее отторжение, будут служить источником органов для трансплантации человеку. Трансгенные птицы Микроинъекция ДНК в оплодотворенные яйцеклетки птиц с целью получения трансгенных линий — непростая процедура. Это связано с некоторыми особенностями воспроизводства и развития птиц. Так, при оплодотворении у птиц в яйцеклетку могут проникнуть сразу несколько сперматозоидов, а не один, как это обычно бывает у млекопитающих, и идентифицировать тот мужской пронуклеус, который соединится с женским, становится невозможно. Метод микроинъекции ДНК в цитоплазму тоже не подходит, поскольку в этом случае ДНК не интегрируется в геном оплодотворенной яйцеклетки.
Наконец, даже если удастся осуществить микроинъекцию ДНК в ядро, дальнейшие операции будет трудно осуществить, поскольку у птиц яйцеклетка после оплодотворения достаточно быстро обволакивается прочной мембраной, покрывается слоем альбумина и внутренней и наружной известковыми оболочками. Однако трансген можно вводить в область желтка (зародышевый диск), который содержит и женский, и мужской пронуклеусы и образуется раньше, чем скорлупа.
После введения ДНК каждую яйцеклетку культивируют in vitro, и когда образуется зародыш, его помещают в суррогатное яйцо, чтобы имитировать вылупление. При помощи такой стратегии была получена одна линия трансгенных цыплят.
Однако в настоящее время этот метод неэффективен и технически трудновыполним в обычных условиях. К тому времени, когда наружная известковая оболочка яйцеклетки птиц затвердевает, зародыш, находящийся на стадии бластодермы, состоит из двух слоев по 40 000 и 80 000 клеток. Проведены эксперименты по инокуляции такого зародыша ретровирусными векторами с нарушенной репликацией, несущими бактериальные маркерные гены. В результате были получены трансгенные цыплята и обыкновенные перепела, несущие чужеродные гены в клетках зародышевой линии. Обычно такие птицы не продуцируют свободных вирусных частиц, и тем не менее применение ретровирусных векторов в качестве «поставщиков» чужеродных генов животным, которые затем могут использоваться в пищу, неизбежно вызывает вопросы относительно безопасности такого подхода. Кроме того, размер трансгена, который может быть введен в организм реципиента в составе ретровирусного вектора, не превышает 8 т. Н., а в некоторых случаях интеграция в исходный сайт нестабильна.
Все это заставило исследователей искать альтернативные способы трансгеноза. Никаких специфичных для птиц ЕS-клеток не обнаружено, поэтому подход, основанный на их использовании, для птиц неприменим. Более перспективным представляется метод с использованием рекомбинантных эмбриональных клеток. Он состоит в следующем. Выделяют клетки бластодермы из куриного эмбриона, трансфицируют их с помощью катионных липидов (липо-сом), связанных с трансгенной ДНК (липосомная трансфекция), и повторно вводят в подзародышевую область свежеотложенных яиц (рис. Часть потомков будет нести в каком-то небольшом количестве клетки донора: таких животных называют химерами.
У некоторых химер клетки, произошедшие от трансфицированных клеток, могут образовывать линии зародышевых клеток, и после нескольких раундов скрещиваний таких химер можно получить линии трансгенных животных. Чтобы увеличить вероятность создания химер, несущих чужеродные гены в клетках зародышевой линии, число донорских клеток в химерах можно увеличить облучением эмбрионов реципиента перед введением в них трансфицированных клеток (540-660 рад в течение 1 ч).
Под действием облучения некоторые (но не все) клетки бластодермы погибнут, и соотношение между трансфицированными клетками и клетками реципиента увеличится в пользу первых. Discover english 3 скачать аудио. По-видимому, таким образом можно получать трансгенных цыплят, хотя и с малой эффективностью.
Навигация
- Проект Оповещения На Variodyn
- Голіцинський Граматика 5 Видання
- Hansa Comfort Plus 1200 Инструкция
- Учебник Истоки 5 Класс
- Презентация Перевозка Опасных Грузов
- Драйвер Avermedia Hybrid Express Dvb
- Скрипт Добавить В Избранное
- Драйвера На Видеокарту Nvidia Geforce 7300Gt
- Учебник Административное Право Миронов А.н. 2011Г
- Утвержденный Фгос Доу 2013
- Драйвер Для Создания Виртуального Ком Порта
- Кряк Для Rs File Repair
- Watson Mp3 Плеер 2Gb Инструкция
- Alesis Dm6 Usb Kit Инструкция
- Lg-Utils-0.4.2
- Карбюратор К 16 Инструкция
- Игра Винкс Клуб Прохождение
- Программа Танцующие Головы Для Андроид
- Геометрия Потоскуев
- Мануал Для Kipor Kge 6500 E
- Чем Открыть Obb Файл
- Нумерологический Процессор Пифагор
- Конвертер M3U В Xml
- Игру Гта Через Торрент Без Вирусов
- Концепция Проекта Развития Организации
- Программа Для Снятия Логов
- Книгу По Ремонту Howo
- Ключ Активации Программы Driver Updater
- Брубек Босса Нова Ноты
- Топокарты Генштаба Тверской Области





